
HOTLINE
发布时间:2019-12-23 作者:采集侠 点击量:
光合作用能量转化终极“阀门”长这样
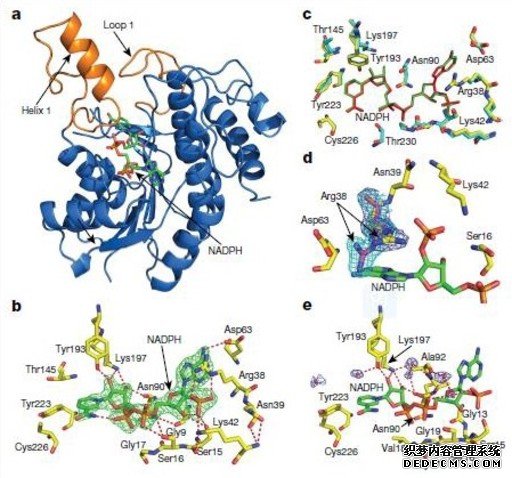
LPOR-NADPH晶体结构 程奇供图
“万物生长靠太阳”,地球上的生命所用能量均是通过光合作用直接或间接转化而来。10月24日,《自然》在线发表叶绿素生物合成关键酶三维结构解析论文,首次解析了叶绿素生物合成关键酶——光依赖型原叶绿素酸酯氧化还原酶(LPOR)的三维晶体结构,揭开了光合作用终极能量来源的生物学转化“阀门”真实结构。
该成果由中国农业科学院生物技术研究所(以下简称生物所)微生物功能基因组创新团队程奇课题组联合国内外相关单位共同完成。科学家阐明了光驱动酶的结构学基础和光依赖型还原酶的动力学机制,填补了近一百年来光合作用途径中,叶绿素生物合成关键酶的三维结构的空白。
论文共同通讯作者、生物所程奇博士介绍,LPOR是蓝细菌、藻类和多细胞植物叶绿素合成的关键酶,与黄化幼苗的转绿能力直接相关,对绿色植物的生长发育至关重要。该关键酶发现至今已近百年,其蛋白的结构及作用机理解析对光合作用的理论和应用研究意义重大,是该领域亟待解决的重大科学问题之一。
该研究报道了在不同衍射率下的LPOR酶单体、LPOR-NADPH蛋白复合体的晶体结构。通过对LPOR晶体结构的解析及LPOR-NADPH-原叶绿素酸酯三元复合物的精准建模,阐明了LPOR蛋白催化原叶绿素酸酯转化为叶绿素酸酯的精准过程,为植物如何利用光能驱动酶催化提供了重要信息,也为定量的能量转化反应精细计算分析铺平了道路。同时,对光催化的化学和生物催化剂及相关蛋白小分子抑制剂的工程化设计均具有重要意义。
相关论文信息:https://doi.org/10.1038/s41586-019-1685-2
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。